Роль циркадного ритма в этиологии сахарного диабета

Патофизиология СД 2 типа
Повсеместное распространение сахарного диабета 2 типа (СД2) достигло масштабов эпидемии и, по оценкам, поражает более 400 миллионов человек во всем мире (174). Более того, ожидается, что заболеваемость диабетом будет продолжать расти, и, по прогнозам, только в США к 2050 году она затронет почти каждого третьего человека (8). Эти тревожные прогнозы позволяют предположить, что существует настоятельная необходимость в разработке и внедрении новых стратегий профилактики и лечения для борьбы с ростом распространенности СД2 во всем мире. СД2 начинается с развития гипергликемии натощак и постпрандиальной гипергликемии, которая является основной причиной возникновения многочисленных опасных для жизни осложнений и сопутствующих заболеваний (153). Этиология гипергликемии при СД 2-го типа представляет собой сложный многофакторный процесс (127). Тем не менее, это может быть связано с прогрессирующими нарушениями чувствительности к инсулину (т.е. инсулинорезистентностью) и соответствующей неспособностью островков поджелудочной железы вырабатывать нужное количество инсулина, чтобы компенсировать данную инсулинорезистентность (т.е. недостаточность островков) (55). (РИСУНОК 1). Патофизиологические проявления резистентности к инсулину и недостаточности островков обнаруживаются на ранних этапах развития заболевания и необходимы для его развития (28).
Резистентность к инсулину проявляется в снижении способности инсулина к активации клеточного сигнального каскада и, следовательно, стимуляции инсулин-опосредованных клеточных процессов. Патофизиология СД2 в основном обусловлена индукцией инсулинорезистентности скелетных мышц, печени и жировой ткани (27). Поскольку скелетные мышцы являются основным органом, ответственным за удаление постпрандиальной глюкозы, резистентность к инсулину в скелетных мышцах серьезно ограничивает способность к утилизации глюкозы у пациентов с СД2 (102).
На клеточном уровне инсулинорезистентность в мышцах выражается благодаря: 1) нарушению инсулин-опосредованного связывания переносчика глюкозы GLUT4 с плазматической мембраной, 2) уменьшению способности к накоплению гликогена, 3) снижению окисления глюкозы и 4) нарушению функции митохондрий (27). В печени резистентность связана с чрезмерной скоростью выработки глюкозы при голодании, что частично объясняется неудачной инсулин-опосредованной супрессией глюконеогенеза (84). Резистентность к инсулину в печени также связана с неспособностью подавлять выработку глюкозы печенью в постпрандиальном состоянии из-за нарушения подавления глюконеогенеза и гликогенолиза (127). Наконец, инсулинорезистентность в жировой ткани характеризуется нарушенным инсулин-опосредованным транспортом глюкозы, сниженной способностью к захвату липидов и нарушением подавления липолиза и воспаления, что приводит к повышенному уровню свободных жирных кислот (СЖК) и цитокинов в плазме (145).
На клеточном уровне индукция инсулинорезистентности в значительной степени связана с эктопическим накоплением липидов в чувствительных к инсулину тканях (т.е. в печени, скелетных мышцах и жировой ткани) (133, 145). В мышцах и печени эктопическое отложение липидов связано с внутриклеточной аккумуляцией в результате ожирения и последующим переходом липидных сигнальных промежуточных продуктов (т.е. церамидов и диацилглицеролов), что играет важную роль в нарушении активации клеточного сигнального каскада инсулина (133, 145). В частности, внутриклеточные диацилглицеролы и церамиды способствуют инсулинорезистентности посредством вредного воздействия на активацию сигнальных молекул инсулина, таких как субстрат инсулиновых рецепторов 1 и 2 (IRS-1 и -2). Этот процесс опосредуется активацией атипичных серин/треонинкиназ, таких как протеинкиназа C (133, 145). Кроме того, ожирение при СД2 также связано с нарушением метаболизма адипоцитов, что приводит к 1) чрезмерному липолизу и, как следствие, повышению уровня свободных жирных кислот в плазме и 2) избыточной продукции и секреции провоспалительных цитокинов (т.е. TNF-альфа, Il-6 и т.д.), которые, как считается, происходят из активированных макрофагов жировой ткани (51).
Таким образом, неправильный метаболизм в жировой ткани при СД2 напрямую способствует резистентности к инсулину в тканях-мишенях через увеличение накопления липидов или косвенно через цитокин-опосредованное нарушение сигнального каскада инсулина в печени и скелетных мышцах (51) (РИСУНОК 1).
Недостаточность панкреатических островков является характерной патологией при СД2 и, наряду с инсулинорезистентностью, необходима для установления гипергликемии (18, 24) (РИСУНОК 1). Основным проявлением недостаточности островков у пациентов с СД2 является отсутствие (или неадекватная активация) глюкозо-опосредованной секреции инсулина и нарушение подавления высвобождения глюкагона (55, 72). Нарушение стимулируемой глюкозой секреции инсулина объясняется секреторной дисфункцией бета-клеток и потерей их количества (т.е. массы бета-клеток) (55, 88). Потеря массы бета-клеток у пациентов с СД2 объясняется повышенным их апоптозом и развитием дедифференцировки (10, 157). Этиология секреторной дисфункции и потери бета-клеток очень сложна. Накопленные данные указывают на индукцию внутриклеточного окислительного стресса и/или стресса эндоплазматического ретикулума, вызванного повышенным токсическим действием гипергликемии/гиперлипидемии и/или островковых амилоидных пептидных олигомеров (IAPP) (42, 114, 136). Механизмы, лежащие в основе нарушения подавления высвобождения глюкагона, недостаточно изучены, при этом ограниченные данные указывают на увеличение числа альфа-клеток и изменения функции альфа-клеток при диабете (72, 91, 139).
СД2 - это сложное метаболическое заболевание, обусловленное взаимодействием различных факторов окружающей среды и генетической восприимчивости (148). Хотя генетические факторы явно играют важную роль в патогенезе СД2, факторы внешней среды и эпигенетические факторы, по-видимому, вносят основной вклад в современный рост распространенности СД2 (35). В связи с этим более поздние данные свидетельствуют о том, что условия окружающей среды, связанные с нарушением нормальных циркадных ритмов, связаны с увеличением числа случаев СД2. В частности, заболеваемость СД2 значительно выше у людей, работающих ночью или сменами; при этом корреляция наблюдается в различных профессиональных отраслях (64, 65, 75, 99, 111, 154). Аналогичным образом, острое нарушение циркадного ритма вызывает изменения метаболизма глюкозы, что способствует развитию диабетогенного состояния в течение нескольких дней/недель после рассогласования ритма, что было воспроизведено в различных клинических лабораторных условиях (11, 21, 74, 95, 119, 135, 141). Кроме того, генетические полиморфизмы и разновидности ключевых циркадных транскриптов связаны с метаболическими нарушениями и повышенной частотой ожирения, гипергликемии и СД2 (37, 81, 140, 168).
Таким образом, существует настоятельная необходимость в разработке новых стратегий профилактики и лечения для снижения распространения СД2 во всем мире. В связи с этим имеется внушительный объем последовательно нарастающих доказательств эпидемиологических, клинических исследований и исследований на животных, связывающих циркадную систему с различными аспектами патофизиологии и лечения СД2. Целью настоящего обзора будет описание новых физиологических и молекулярных представлений о роли циркадной системы в патофизиологии метаболических нарушений, связанных с развитием СД2. Кроме того, особое внимание будет уделено обсуждению терапевтического потенциала нацеливания на ключевые компоненты циркадной системы для лечения и профилактики метаболической дисфункции.
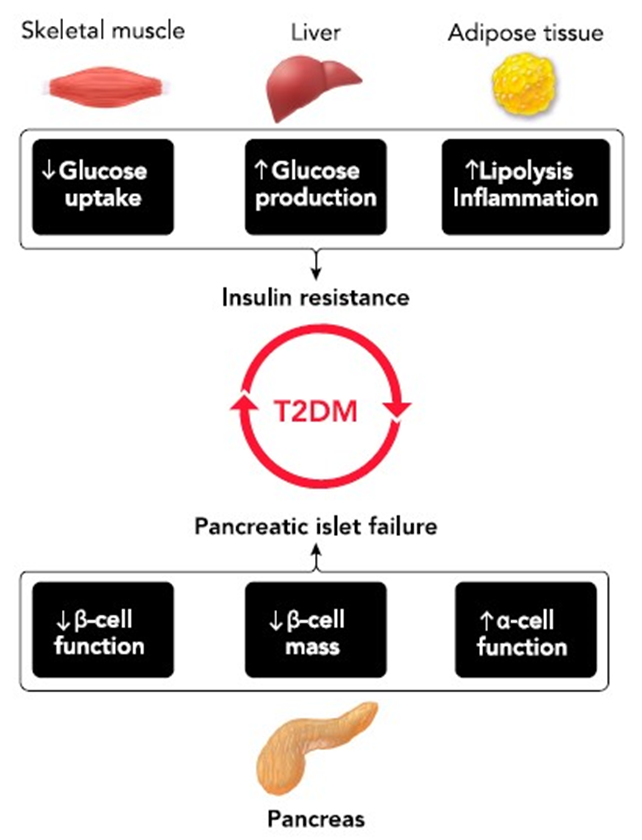
Рис. 1. Патофизиология СД 2 типа.
СД2 – это сложное метаболическое заболевание, патофизиология которого включает в себя связь генетической предрасположенности и действия внешних триггеров. Гипергликемия развивается в результате недостаточности островковых клеток поджелудочной железы вместо системной инсулинорезистентности. Недостаточность островковых клеток при СД2 ассоциирована со снижением количества и функциональной способности бета-клеток и повышенной секрецией глюкагона. Инсулинорезистентность при СД2 в основном проявляется на уровне скелетных мышц, печени, жировой ткани, и характеризуется нарушением инсулин-опосредованного удаления глюкозы, неспособностью к супрессии продукции глюкозы печенью и повышенным липолизом и воспалением в клетках жировой ткани.
Циркадная организация, молекулярная структура и подстройка к суточному ритму.
Большинство организмов в результате эволюции развили оптимальную физиологическую функциональность в условиях окружающей среды, создаваемых ежедневными сменами цикла день-ночь (свет-темнота - СТ).
Движущей силой биологической адаптации к изменениям в цикле СТ является эволюционное развитие циркадной системы (около дня). Эффективность циркадной системы состоит в том, чтобы способствовать адаптации и приспособленности организма в ответ на 24-часовой цикл окружающей среды (например, бодрствование/сон, голодание/кормление и т.д.). Ключевым аспектом циркадной физиологии является ее прирожденная природа, предполагающая наличие внутренней клеточно-специфической временной программы, которая предвидит и регулирует поведенческие, физиологические, генетические и метаболические циклы, подходящие под изменения внешней среды (112). Таким образом, эволюционное происхождение циркадной системы, по-видимому, выбрано для стимуляции адаптации организма к суточным изменениям в окислительной среде, ультрафиолетовому повреждению ДНК, а также к оптимальной суточной регуляции клеточной энергетики и метаболизма (112, 158). Действительно, было показано, что функциональная циркадная система обеспечивает явное преимущество к приспособлению у различных живых организмов, таких как растения (29), бактерии (167), дрожжи (19) и млекопитающие (26, 63)
Организация циркадной системы у млекопитающих
Учитывая фундаментальную важность циркадной системы в физиологии млекопитающих, циркадная ритмичность пронизывает все уровни организма млекопитающих от поведения до гормональной секреции, регуляции температуры, а также молекулярной регуляции транскрипции и трансляции генов (124, 155, 156). Чтобы обеспечить эффективную и точную координацию циркадной синхронизации времени во всем теле, циркадная система организована как многоуровневая иерархическая сеть осцилляторов (РИСУНОК 2). Водитель ритма или «основные-часы» локализуются в подгруппе двусторонних нейронов в супрахиазматическом ядре (СХЯ) гипоталамуса (56, 97, 123, 151). Действительно, нейроны СХЯ, по-видимому, определяют период циркадных ритмов организма и необходимы для генерации циркадных ритмов в большинстве физиологических и поведенческих функций (56, 97). Свет является наиболее заметным стимулом, ответственным за вовлечение «часов» СХЯ в ежедневные изменения в циклах СТ (47). Вовлечение СХЯ часов в циклы окружающей среды осуществляется посредством прямых проекций на сетчатку от специализированных фоторецепторов, обогащенных меланопсином (4). Важно отметить, что опосредованные светом циркадные нейрональные пути отличаются от обычной фототрансдукции, вызванной палочками и колбочками, что дополнительно подчеркивает уникальную природу циркадной системы в физиологии млекопитающих (36).
Самодообеспечивающиеся и автономные клеточные циркадные осцилляторы также присутствуют в широком спектре периферических тканей/клеток, включая ткани, критически важные для метаболического контроля, такие как скелетные миоциты, гепатоциты, адипоциты и островковые клетки поджелудочной железы (132). (Рисунок 2). Эти клеточно-автономные осцилляторы способны поддерживать 24-часовой циркадный ритм в выполнении клеточных специфических функций без непрерывного вывода из СХЯ (170). Тем не менее, основная функция «часов» СХЯ, по-видимому, заключается в координации и синхронизации тканевых циркадных осцилляторов посредством комбинации нейрональных, гуморальных и поведенческих сигналов, таким образом объединяя сложную многоуровневую иерархическую сеть осцилляторов (РИСУНОК 2).
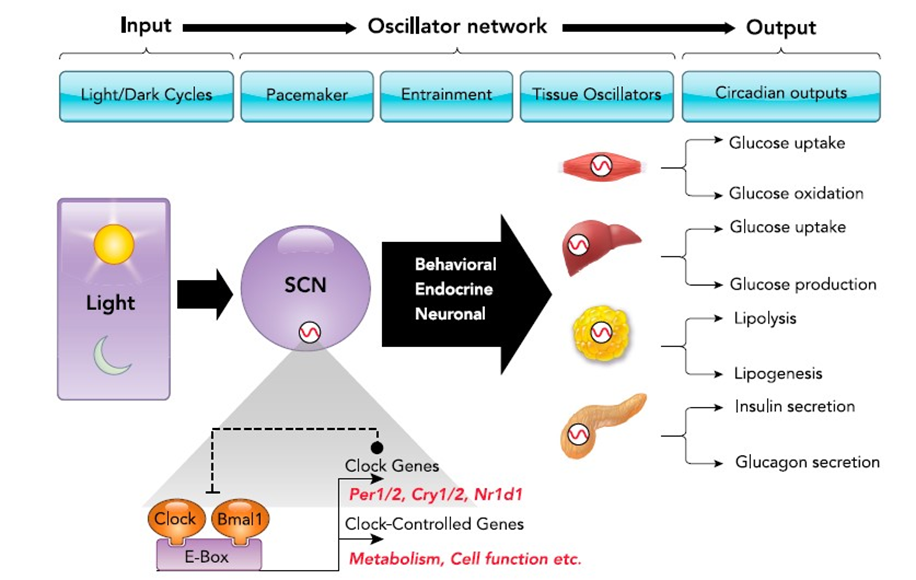
Рис. 2. Организация и молекулярная структура циркадной системы млекопитающих.
Чтобы обеспечить эффективное согласование с циркадным временем, циркадная система млекопитающих организована как многоуровневая иерархическая сеть осцилляторов. Изменения в цикле СТ воспринимаются специализированными ганглиозными клетками в сетчатке, синхронизируя центральный водитель ритма циркадной системы в СХЯ с солнечным днем. Основная функция «часов» СХЯ, по-видимому, координинация и синхронизация клеточных автономных циркадных осцилляторов, присутствующих в широком спектре периферических тканей (например, скелетных миоцитах, гепатоцитах, адипоцитах и островковых клетках поджелудочной железы) посредством комбинации нейрональных, гуморальных и поведенческих сигналов, таким образом интегрируя сложную многоуровневую иерархическую сеть осцилляторов. Молекулярная структура циркадных осцилляторов состоит из активаторов транскрипции CLOCK и его гетеродимера BMAL1, а также генов-репрессоров, которые кодируют периодические (PER1, 2) и криптохромные (CRY1, 2) белки. Этот регуляторный механизм обеспечивает генерацию 24-часовых циклов транскрипции и трансляции. В частности, система CLOCK:BMAL1 необходима для генерации циркадных ритмов транскрипции посредством связывания ДНК с консервативными промоутерными областями (Е-боксами) многочисленных контролируемых «часами» генов, критически важных для регуляции разнообразных клеточных функций и метаболических путей.
На сегодняшний день точный физиологический механизм, с помощью которого СХЯ синхронизирует работу периферических осцилляторов, остается областью активного исследования. Тем не менее, накопленные данные показывают, что СХЯ использует несколько биологических путей, чтобы регулировать подстройку под суточные фазы и циркадную физиологию генераторов колебаний периферических тканей. В частности, как парасимпатическая, так и симпатическая части вегетативной нервной системы опосредуют СХЯ-зависимую регуляцию циркадных ритмов (57, 97, 162). Например, циркадные ритмы в выработке глюкозы печенью и окружающей гликемии основаны на СХЯ-опосредованном автономном контроле циркадных часов печени (66). СХЯ также регулирует циркадную работу периферических осцилляторов косвенно посредством модуляции циклов голодания/кормления, что особенно заметно у типов клеток, реагирующих на ежедневные проблемы с питанием (например, островки поджелудочной железы и гепатоциты) (25, 121). Хотя точные механизмы, обеспечивающие циркадную подгонку, связанную с питанием, периферических осцилляторов неизвестны, были предложены комбинации гормональных факторов, связанных с работой кишечника, и метаболитов, связанных с поступлением пищевых продуктов (98). Наконец, СХЯ также синхронизирует циркадные ритмы посредством регуляции температуры и ритмичности выброса гормонов (например, глюкокортикоидов) (68, 137). В целом, СХЯ играет центральную роль в организации работы периферических осцилляторов, используя обильные сигнальные механизмы для точной настройки временной регуляции различных циркадных ритмов у млекопитающих (РИСУНОК 2).
Молекулярные механизмы клеточных автономных циркадных часов
Молекулярный состав СХЯ и периферических циркадных осцилляторов практически идентичен и состоит из клеточно-автономной транскрипционно-трансляционной петли обратной связи, регулируемой набором основных «тактовых» генов (РИСУНОК 2). Новаторская работа Хардина, Холла и Росбаша впервые определила ген «Периода» (Per) в качестве основного компонента цикла циркадных осцилляторов у дрозофилы, что обеспечило раннее механистическое понимание функции циркадных часов (44, 45). У млекопитающих ядро циркадных часов содержит транскрипционные факторы CLOCK и его гетеродимер BMAL1 (также известный как Arntl или Mop3), а также репрессорные гены, которые кодируют белки «периода» (PER 1,2) и криптохромы (CRY 1,2) (155, 156). Вторичные регуляторные петли с участием ядерных рецепторов Rev-erb альфа/бета и ROR альфа/бета обеспечивают дополнительную молекулярную стабилизацию и контроль, действуя в качестве соответствующих транскрипционных репрессоров и активаторов Bmal1 (115). Вместе этот регуляторный механизм обеспечивает генерацию надежных 24-часовых циклов транскрипции и трансляции с различными фазами экспрессии. В частности, гетеродимер CLOCK-BMAL1 активирует транскрипцию генов-мишеней посредством связывания ДНК с консервативными промоторными областями (E-box). Это включает рекрутирование и взаимодействие с гистонацетилтрансферазами (например, р300), метилтрансферазами (например, MLL1), гистоновыми деметилазами (Jarid1a) и специфичными для клетки энхансерами (например, PDX1 в бета-клетках) для улучшения доступности хроматина и таким образом способствуют активации транскрипции генов-мишеней (155). Действительно, до 20% генома в большинстве исследованных типов клеток демонстрируют некоторую форму регуляторного контроля циркадными часами, которая включает регуляцию транскрипции, трансляции, деградации мРНК, обмена микроРНК и сплайсинга ( 155). Примечательно, что большая часть генов, контролируемых «часами», участвует в регуляции клеточного метаболизма (31, 67). Таким образом, изменения в гомеостазе глюкозы и склонность к ожирению и диабету были одними из самых ранних фенотипических наблюдений, отмеченных на моделях мышей с мутации генов «часов» (128, 161).
Циркадные часы как клеточно-специфические регуляторы гомеостаза глюкозы
Роль циркадных часов скелетных мышц в гомеостазе глюкозы
Исследования как in vitro, так и in vivo четко продемонстрировали наличие надежных самодостаточных и автономных циркадных осцилляторов в скелетных миоцитах (43, 104). В частности, устойчивая циркадная ритмичность существует почти для каждого аспекта физиологии скелетных мышц, критически важного для правильной регуляции гомеостаза глюкозы. Это включает циркадные изменения экспрессии и транслокации GLUT4-транспортера глюкозы в скелетных мышцах (30), поглощения и окисления глюкозы (32, 73), отложения гликогена (73), окислительной способности митохондрий (163), а также метаболизма белков и жиров. Например, пик физиологической активности поглощения и окисления глюкозы в скелетных мышцах совпадает с началом циркадных циклов активности/питания в экспериментах на мышах и людях, что согласуется с основной ролью циркадной системы в повышении метаболической гибкости (73, 163). Важно отметить, что циркадные ритмы в функциях скелетных мышц (например, поглощение глюкозы) сохраняются в изолированных мышечных клетках in vitro, что предполагает контроль транскрипции с помощью эндогенного циркадного часового механизма (32, 104). Кроме того, СД2 связан с нарушениями циркадного контроля усвоения и окисления глюкозы в мышцах, что подразумевает нарушение работы циркадных часов в качестве фактора, способствующего патофизиологии инсулинорезистентности скелетных мышц при диабете (5, 32, 82).
Наиболее убедительные доказательства ключевой роли биологических часов в регуляции физиологии скелетных мышц получены в исследованиях на мышах с удаленным геном Bmal1. Bmal1 является критическим «часовой» геном, необходимым для правильной работы основных циркадных часов (9). Действительно, Bmal1 является единственной не резервной делецией генов «часов», которая приводит к нарушению поведенческих, физиологических и молекулярных циркадных ритмов (63, 90). Важно отметить, что полная делеция Bmal1 характеризуется поразительным снижением массы, функции и плотности митохондрий скелетных мышц, что можно вернуть при специфическом для мышц трансгенном восстановлении (2, 63, 90). В последние годы были разработаны модели мышей с удаленным специфическим для скелетных мышц геном Bmal1, чтобы определить его роль в регуляции метаболизма глюкозы. Интересно, что как эмбриональные, так и взрослые мышечно-специфические Bmal1 удаления первоначально демонстрируют глубокую потерю толерантности к глюкозе и инсулину, обусловленную в основном нарушением инсулин-опосредованного поглощения глюкозы, сродни патологии, характерной для инсулинрезистентных пациентов с СД2 (30, 46, 50).
На клеточном уровне отсутствие поглощения глюкозы из-за делеции Bmal1 связано с уменьшением экспрессии и транслокации переносчиков глюкозы GLUT4, опосредованной снижением экспрессии TBC1D1, ключевого белка, участвующего в транслокации GLUT4 по цитоплазме к плазматической мембране (30, 46). Примечательно, что сниженный транспорт глюкозы также наблюдается в скелетных мышцах пациентов с СД 2 (102). Кроме того, делеция мышечного Bmal1 также ослабляет экспрессию и ферментативную активность ключевых метаболических ферментов, необходимых для метаболизма глюкозы (например, гексокиназы) и последующего окисления глюкозы (например, пируватдегидрогеназы), что направляет клеточный метаболизм в сторону большего использования и запасания липидов. Это повторяет фенотипические изменения, наблюдаемые в скелетных мышцах пациентов с СД2 (30, 46). В целом, имеются убедительные экспериментальные доказательства того, что циркадные часы скелетных мышц являются ключевым регулятором инсулин-опосредованного транспорта, поглощения, накопления и окисления глюкозы и, будучи нарушенными, способствуют развитию СД2.
Роль циркадных часов печени в гомеостазе глюкозы
Печень является одним из главных органов, отвечающих за суточный контроль гомеостаза глюкозы (106). В условиях голодания дневные колебания скорости выработки глюкозы в печени определяют циркадные изменения гликемии в крови. Таким образом, удаление СХЯ (или специфичных для печени) циркадных часов приводит к аннулированию работы циркадных ритмов концентрации глюкозы в крови и приводит к нарушению гомеостаза глюкозы (1, 58). Печень также способствует циркадному контролю метаболизма постпрандиальной глюкозы, поскольку циркадные изменения в степени выработки глюкозы печенью также являются ключевыми детерминантами суточных циклов чувствительности к инсулину и толерантности к еде (6, 22, 130). Кроме того, было показано, что все ключевые метаболические и ферментативные определяющие факторы продукции глюкозы в печени (т.е. скорости глюконеогенеза, гликогенолиза и накопления гликогена) демонстрируют устойчивые циркадные вариации у человека и различных животных моделей (60, 73, 82, 110).
На клеточном уровне гепатоциты демонстрируют отчетливые циркадные колебания (осцилляции) в транскрипции, трансляции и морфологических особенностях, таких как размер и объем клеток (3, 89, 100, 146, 166). В частности, гепатоциты демонстрируют циркадные паттерны экспрессии для метаболических генов, необходимых для регуляции поглощения и хранения глюкозы в печени (например, Glut2 и Gck), продукции глюкозы в печени (например, Pepck и Gcgr), а также клеточных процессов, участвующих в окислении и хранении липидов (например, Cpt1 и Li-pin1) (67, 100). Кроме того, протеом печени (как ядерный, так и цитоплазматический) также подвергается значительным суточным регуляциям, особенно в биологических процессах, связанных с репарацией ДНК, пролиферацией, рибосомным биогенезом и внутриклеточным транспортом белка (166). Важно отметить, что циклы голодания-кормления, по-видимому, являются основными временными сигналами, регулирующими многие суточные ритмы в функции печени и связанные с ней суточные колебания в транскриптоме и протеоме печени (3, 89, 152, 164). Таким образом, при оценке механизмов, ответственных за генерацию циркадных ритмов в печени, следует различать зависящие от «часов» и независимые от «часов» (т.е. управляемые питанием) циркадные ритмы, оба из которых способствуют генерации суточных колебаний в печени.
Иммунопреципитация хроматина в сочетании с исследованиями глубокого секвенирования (ChIP-Seq) пролили некоторый свет на потенциальные молекулярные мишени и механизмы, управляющие регуляцией транскрипции, контролируемой «часами» в гепатоцитах. В частности, Рей и его коллеги (126) определили карту всего генома, соответствующую более 2000 сайтам связывания BMAL1 в печени. Важно, что наиболее заметные сайты связывания были обогащены промоутерными областями генов, регулирующих метаболизм глюкозы в печени (например, Glut2 и G6pc) и липидов (например, Agpat6 и Dgat2), таким образом, дополнительно указывая на то, что «часы» печени являются ключевыми медиаторами гомеостаза глюкозы (126). В соответствии с этим открытием, специфичная для печени делеция Bmal1 у мышей приводит к потере циркадной регуляции генов, необходимых для регуляции метаболизма глюкозы в печени, таких как транспортер глюкозы Glut2, что приводит к нарушению регуляции при системной гликемии и толерантности к глюкозе (67). Совсем недавно Jacobi и коллеги (53) пошли дальше в своих исследованиях, чтобы продемонстрировать, что печеночный Bmal1 управляет внутриклеточной динамикой митохондрий (делением и митофагией) и играет важную роль в регуляции окислительной способности печени. Следовательно, специфическая для печени делеция Bmal1 повторяет печеночную патологию при СД2, характеризующуюся повышенным окислительным стрессом, потерей сигналов инсулина, накоплением эктопических липидов и резистентностью к инсулину в печени (53).
Печеночные часы также управляют регуляцией клеточного метаболизма через «косвенные» пути, опосредованные активацией транскрипционных факторов и других транскрипционных и трансляционных регуляторов (12, 40, 138, 171, 172). Исследования ChIP-Seq показывают «регуляцию транскрипции» как наиболее обогащенный аннотированный функциональный кластер сайтов связывания BMAL1 в печени, который включает 82 фактора транскрипции ДНК и 18 экспрессируемых в печени ядерных рецепторов (126). В частности, печеночные «часы» регулируют метаболизм липидов и холестерина через BMAL1: CLOCK-опосредованную трансактивацию Klf10 (Kruppel-подобный фактор транскрипции) и ядерный рецептор Ppar -альфа (рецептор, активируемый пролифератором пероксисом альфа) (12, 40). Интересно, что Klf10 и Ppar-альфа также регулируют активацию промотора Bmal1, тем самым подчеркивая сложную взаимосвязь между циркадными часами и метаболизмом в печени (12, 40). Наконец, исследования также показывают, что белки-репрессоры циркадных часовых (например, CRY 1 и 2 и PER2) координируют циркадный контроль над метаболизмом глюкозы в печени посредством посттрансляционной регуляции передачи сигналов цАМФ и функции ядерного рецептора (138, 171). Например, Zhang et al. (171) красноречиво продемонстрировали, что циркадная экспрессия CRY1 ингибирует активацию ключевых глюконеогенных ферментов посредством прямого связывания и ингибирования субъединицы Gs-альфа рецептора печеночного глюкагона, в то время как гиперэкспрессия печенью Cry1 приводила к ослабленному глюконеогенезу и пониженной гликемии у мышей с диабетом. В целом, накапливающиеся данные выдвигают на первый план печеночные «часы» как важный транскрипционный/трансляционный регулятор продукции глюкозы печенью, ее захвата и чувствительности к инсулину, подчеркивая тем самым их потенциал в качестве терапевтических целей при СД2 (160).
Роль циркадных часов адипоцитов в гомеостазе глюкозы
Белая жировая ткань (БЖТ) выполняет двойную цель в регуляции гомеостаза глюкозы благодаря своей роли как энергетического депо и благодаря своим разнообразным функциям, связанным с эндокринной системой. БЖТ - это центральное энергетическое депо, в котором содержатся триглицериды (ТГ), которые используются в процессе липолиза [т.е. расщепление ТГ на свободные жирные кислоты (СЖК) и глицерин]. Таким образом, правильная регуляция липолиза и липогенеза, имеет решающее значение для поддержания нормального гомеостаза глюкозы, так как избыток циркулирующих СЖК способствует эктопическому отложению липидов и, как следствие, развитию инсулинорезистентности при СД2 (145). Действительно, циркадные изменения концентрации свободных жирных кислот в плазме давно описаны у людей (14), данное явление недавно связали с циркадными изменениями в активации инсулинового каскада в жировой ткани (13).
Из-за сильных дневных изменений энергетических потребностей млекопитающих было показано, что процессы в жировой ткани, включая липолиз, адипогенез и метаболическое воспаление, регулируются циркадными часами (142, 143, 169). Соответственно, индукция ожирения из-за чрезмерного уровня триглицеридов в плазме и свободных жирных кислот характерно наблюдается у мышей с мутацией Clock и/или Bmal1 (128, 161). Кроме того, исследования, проведенные как на грызунах, так и на людях, позволили выявить ритмично экспрессируемые управляемые «часами» гены в различных депо жировой ткани (77, 143, 175), выявляя профили циркадной экспрессии для тысяч генов, критически важных для правильной регуляции метаболизма адипоцитов ( 175). Например, в одном исследовании было показано, что высвобождение СЖК и глицерина регулируется «часами» благодаря транскрипционной регуляции двух ключевых ферментов стимуляции липолиза (например, Atgl и Hsl) гетеродимером BMAL1 и CLOCK (144). Кроме того, у мышей без гена Bmal1 выявлена более низкая способность адипоцитов синтезировать полиненасыщенные жирные кислоты из-за более низких уровней экспрессии двух ключевых генов, участвующих в удлинении и десатурации СЖК, Elov16 и Scd1, которые, как было показано, также транскрипционно контролируются Bmal1 (101).
Помимо работы в качестве энергетического депо, жировая ткань считается одним из крупнейших эндокринных органов в организме из-за ее неограниченного потенциала роста и способности секретировать различные гормоны и цитокины. Количество адипокинов, которые, как известно, секретируются адипоцитами при ожирении и диабете, расширилось и включает лептин, адипонектин, резистин, висфатин и оментин, в дополнение к воспалительным цитокинам, таким как TNF-альфа, ИЛ-6, MCP-1 и другим.
Одним из наиболее известных источников провоспалительных цитокинов при индуцированной ожирением резистентности к инсулину являются макрофаги жировой ткани (МЖТ) (51, 79). В «диабетических условиях» показано, что МЖТ претерпевают переход от противовоспалительных макрофагов М2 к провоспалительным макрофагам М1, которые являются известными продуцентами провоспалительных цитокинов, таких как TNF-α, IL-6 и IL-12 (79). , Хотя роль циркадной системы в контроле воспаления жировой ткани не совсем понятна, накапливаются свидетельства того, что помехи в циркадных путях могут вызывать воспалительные реакции. Например, у мышей с ожирением с нарушенным циркадным ритмом отмечалось усиление ожирения, связанное с повышенной экспрессией ключевых жировых воспалительных маркеров, таких как антиген макрофага-1 (MAC1) и TNF-β в БЖК (33). Кроме того, макрофаги с нарушенным ритмом (мутации Per2) демонстрировали усиление провоспалительной активации в условиях-LPS и повышенную поляризацию макрофагов M1 в БЖТ (169). Интересно, что эти результаты были дополнительно воспроизведены у мышей с ожирением с нарушением экспрессии Per1/2 миелоидными клетками, опосредованными посредством подавления макрофагами PPAR-гамма, ключевого регулируемого «часами» фактора транскрипции, участвующего в поляризации макрофагов М2 (169). В целом, убедительные данные свидетельствуют о том, что множественные аспекты биологии жировой ткани (например, чувствительность к инсулину, липолиз, липогенез, воспалительные пути и т.д.) Контролируются циркадными часами, нарушение работы которых приводит к усиленному ожирению, инсулинорезистентности и повышенной восприимчивости к развитию СД2.
Роль островковых циркадных часов в гомеостазе глюкозы
У людей циркадные изменения в толерантности к глюкозе и еде уже давно признаны отличительной чертой гомеостаза глюкозы (14, 69, 130). В самом деле, повышенная толерантность к глюкозе проявляется в начале активного циркадного цикла и связана с большей секреторным выбросом инсулина в ответ на глюкозу и специфические для бета-клеток стимуляторы секреции (14). В подтверждение этих ранних наблюдений в классических исследованиях Бодена и его коллег использовался 72-часовой протокол поддержания уровня глюкозы, чтобы продемонстрировать надежные независимые от гликемии и питания секреторные паттерны циркадного инсулина у людей (7). Кроме того, циркадные ритмы в секреции инсулина, стимулированной глюкозой, сохраняются in vitro в культивируемых изолированных островках поджелудочной железы человека (и грызунов), а также в очищенных популяциях бета-клеток, что предполагает регуляторный контроль клеточно-автономных циркадных часов (103, 105, 108). Хотя циркадная регуляция выработки глюкагона альфа-клетками гораздо менее понятна, исследования также показывают циркадные изменения секреции глюкагона in vivo, в культивируемых островках и в очищенных альфа-клетках in vitro (85, 129, 130).
Наличие и функционирование автономно-клеточных циркадных часов в островках поджелудочной железы было изучено и подтверждено множеством групп, использующих метод для отслеживания биолюминесценции островковых клеток in vitro с помощью слияния люциферазы с генами «часов» (например, Per1:LUC и Per2: LUC) (87, 107, 108, 116–118, 121). В совокупности эти исследования показывают, что островковые клетки 1) демонстрируют устойчивые автономные циркадные ритмы в экспрессии генов «часов» с четко выраженным ~ 24-часовым периодом, фазой и амплитудой циркадных колебаний, и 2) СХЯ, по-видимому, определяет фазу циркадных часов в островках с помощью модуляции пищевого поведения (121). Также было продемонстрировано, что функция островковых циркадных часов изменяется под воздействием циркадных нарушений, вызванных изменениями фотопериода и/или воздействия избыточного питания (117, 118). Наконец, совсем недавно, Петренко и его коллеги использовали новую модель мыши с тройным генератором, чтобы показать присутствие надежных клеточно-автономных циркадных осцилляторов в очищенных популяциях бета- и альфа-клеток, которые были характеризованы разными фазами в транскрипции и функциональных осцилляций (108).
На клеточном уровне «часы» островковых клеток управляют циркадными колебаниями в транскриптоме, сродни другим метаболически активным типам клеток (то есть печени и скелетным мышцам) (103, 108, 122). Действительно, большая доля транскриптов в островках мыши (до трети) демонстрирует статистически значимые циркадные профили (103). Циркадные экспрессируемые транскрипты в островковых клетках преимущественно обогащены биологическими путями, регулирующими секрецию и экзоцитоз инсулина (например, SNARE-взаимодействия, везикулярный транспорт и экзоцитоз), функцию митохондрий, обработку и транспорт белка ЭПР, а также транскриптами, участвующими в регуляция клеточного оборота (например, репликация ДНК и реакция на повреждение и репарацию ДНК) (103, 108, 122). Важно отметить, что недавно было показано, что очищенные популяции подтипов островковых клеток отображают подмножество циркадных транскриптов, специфичных для альфа- и бета-клеток, с соответствующей пиковой экспрессией во время неактивного/голодного или активного/во время еды циркадного цикла, соответствующего пику секреции глюкагона и инсулина (108).
На молекулярном уровне в недавней работе Перелиса и соавторов (103) продемонстрировано, что циркадный контроль секреции инсулина и регуляции транскрипции островков осуществляется посредством ритмического связывания ДНК гетеродимера CLOCK: BMAL1 с ключевым фактором транскрипции островков, PDX-1, наряду с одновременным пополнением специфических для островковых клеток энхансеров. Следовательно, учитывая широко распространенное значение циркадных часов в регуляции транскрипции островков и гормональной секреции, многие группы в настоящее время продемонстрировали индукцию непереносимости глюкозы, гипергликемии и нарушение стимулированной глюкозой секреции инсулина в поджелудочной железе и мутантных по гену clock бета-клеток. (71, 87, 103, 120, 131). Более того, разрушение «часов», специфичных для бета-клеток, также ставит под угрозу репликативную способность бета-клеток и способствует апоптозу, вызванному повреждением ДНК, что, вероятно, связано с увеличением внутриклеточной окислительной среды и индукцией стресса ЭПР (70, 120). Взятые вместе, островковые циркадные «часы», по-видимому, играют существенную роль в регуляции бета- и альфа-клеточной функции и оборота. Следовательно, островки с нарушенным ритмом повторяют как функциональные, так и морфологические нарушения, связанные с недостаточностью островков при СД2.
Циркадная система как новая терапевтическая мишень при СД2
Появляется все больше доказательств того, что терапевтические стратегии, предназначенные для усиления функции циркадных часов, могут быть полезны для профилактики и лечения заболеваний с метаболическими нарушениями, таких как СД2. Во-первых, как указано в настоящем обзоре, клеточно-автономные циркадные часы управляют регуляцией физиологических функций, необходимых для поддержания нормального гомеоза глюкозы (например, усвоение глюкозы скелетными мышцами, выработка глюкозы в печени, липолиз жировой ткани и функционирование островковых клеток) (30, 46, 53, 103, 142). Соответственно, фенотипические характеристики многих мышей с мутантным геном «часов» повторяют патофизиологию, обычно наблюдаемую у пациентов с СД2, такую как резистентность к инсулину, избыточная продукция глюкозы в печени, накопление эктопического жира, нарушение секреции инсулина и потеря бета-клеток (30, 46, 53, 103, 120, 142). Во-вторых, патогенез ожирения и СД2 как таковой связан с нарушениями циркадной регуляции как на уровне центральных, так и периферических циркадных осцилляторов (16, 39, 61, 92, 134). Таким образом, развитие ожирения и СД2 у людей подтверждается нарушением циркадной физиологии (5, 54, 69, 82, 86, 125, 150). В самом деле, у грызунов с диабетом и ожирением наблюдается нарушение поведенческих и метаболических циркадных ритмов, связанных с подавлением трансактивации CLOCK-BMAL1 и нарушением функции циркадных осцилляторов в периферической ткани (например, в печени, скелетных мышцах и островках) (48, 61, 118). Более того, эктопическая экспрессия CLOCK и BMAL1 в чувствительных к инсулину тканях, как было показано, обращает резистентность к инсулину в скелетных мышцах и печени, уменьшает липолиз в адипоцитах и улучшает толерантность к глюкозе на мышиной модели СД2 (76, 142, 173).
Первым терапевтическим средством, базированным на влиянии на циркадные ритмы и проверенным на антидиабетическую эффективность, был мелатонин, гормон, синтезируемый и выделяемый эндокринными клетками шишковидной железы (93). Циркадное производство мелатонина и его секреция приводятся в действие прямыми нейрональными влияниями из СХЯ (94) и, следовательно, циркадная секреция мелатонина была описана как гормональный выброс центральных циркадных часов (109). Действительно, экзогенное введение мелатонина оказывает непосредственное влияние на СХЯ и периферические циркадные осцилляторы через повсеместно экспрессируемые рецепторы мелатонина (38). Впоследствии добавление мелатонина по времени оказалось эффективно для усиления глобальных циркадных ритмов как у грызунов, так и у людей (15, 147). Важно отметить, что инъекции мелатонина у грызунов доказали свою эффективность в снижении ожирения и ослаблении резистентности к инсулину как печени, так и скелетных мышц путем прямого усиления клеточного сигнального каскада инсулина (41, 96). Кроме того, в изолированных островках при СД2 активация передачи сигналов мелатонина, как было показано, ослабляет индукцию окислительного стресса и стресса эндоплазматического ретикулума и улучшает стимулированную глюкозой секрецию инсулина и выживание бета-клеток (23, 159). Хотя в некоторых первоначальных клинических исследованиях на людях сообщалось о положительных эффектах лечения мелатонином для контроля гликемии у пациентов с СД2, необходимы дополнительные хорошо контролируемые клинические испытания, чтобы выяснить потенциальную эффективность мелатонина для профилактики и лечения СД2 у людей (34).
В последние годы все больший упор делался на разработку низкомолекулярных химических усилителей циркадной системы с целью увеличения регулируемых «часами» физиологических процессов (20, 165). Впоследствии был разработан ряд химических соединений, специфически нацеленных на центральный циркадный осциллятор, с документированной эффективностью в модулировании метаболической функции в доклинических исследованиях. В частности, Нобилетин (природный флавоноид) недавно был идентифицирован как усилитель амплитуды работы «часов», действия которого опосредованы активацией ядерного рецептора ROR (48). Важно, что хроническое введение нобилтина в двух различных моделях мышей с ожирением/СД2 привело к восстановлению колебательных паттернов экспрессии циркадного и метаболического генов в печени и соответствующих фенотипических улучшений гликемии, толерантности к глюкозе, резистентности к инсулину и эктопического накопления жира (48). Другой недавно открытый химический модулятор циркадной системы, Rev-ERB-альфа/бета-агонист, также, как было показано, модулирует экспрессию циркадных метаболических генов и снижает гликемию, липидемию и накопление эктопического жира у мышей (149). Более того, Хирота и его коллеги идентифицировали небольшой активатор CRY молекулы (KL001), который препятствует убиквитин-опосредованной деградации CRY, что приводит к стабилизации CRY и удлинению циркадного периода (49). Важно отметить, что управление KL001, как было показано, ослабляет индуцированный глюкагоном глюконеогенный поток в изолированных гепатоцитах in vitro, а также улучшает переносимость глюкозы у мышей с ожирением, устойчивых к инсулину in vivo (49, 52). Наконец, полезные метаболические эффекты, приписываемые химическим модуляторам Rev-ERB-альфа/бета и CRY, не были связаны с повышенной амплитудой работы циркадных часов, что подчеркивает необходимость проведения дополнительных исследований для полного понимания механизмов, лежащих в основе физиологических эффектов химических соединений, изменяющих работу циркадных часов (49, 52).
Заключительные замечания
Циркадная физиология млекопитающих характеризуется исключительной стабильностью временной регуляции многочисленных биологических функций, демонстрирующих период временного разрешения около 24 часов с минимальным коэффициентом дисперсии (112). Однако физиологические преимущества циркадной системы уменьшаются, когда внешние изменения окружающей среды отклоняются от нормы (то есть 24 часа), что становится все более распространенным в современном обществе (80). Это вызывает состояние, часто характеризуемое как циркадное смещение или нарушение (26, 59, 113), состояние, тесно связанное с нарушением обмена веществ и развитием ожирения и СД2 (11, 21, 64, 65, 74, 75, 95, 99). 111, 119, 135, 141, 154). В настоящем обзоре освещаются обширные клинические и доклинические данные, подтверждающие важную роль циркадной системы в регуляции метаболической функции и гомеостаза глюкозы. Эта работа также дает четкое обоснование для терапевтического таргетирования циркадной системы при лечении и профилактике СД2 и коморбидных состояний. Будущие исследования срочно необходимы для выявления и характеристики механизмов действия новых химических и эндогенных модификаторов циркадной системы млекопитающих, которые могут усиливать регулируемые «часами» метаболические и чувствительные к глюкозе физиологические процессы.
Статья опубликована в журнале PHYSIOLOGY 33: 138–150, 2018.
Список литературы доступен по ссылке doi:10.1152/physiol.00003.2018