Атопический дерматит (АтД) – хроническое воспалительное заболевание, развивающееся у лиц с генетической предрасположенностью к атопии, имеющее рецидивирующее течение с возрастными особенностями клинических проявлений, характеризуемое повышенной чувствительностью к специфическим (аллергенным) и неспецифическим раздражителям. АтД рассматривается как проявление атопического марша, под которым понимают типичное прогрессирование клинических симптомов аллергических заболеваний в детском возрасте. Несколько исследований показали, что АтД положительно связан с астмой. Показано, что риск развития бронхиальной астмы у детей с АтД повышен в 2 раза по сравнению с детьми без него [1].
АтД одно из самых распространенных заболеваний детского возраста, поражающее от 15 до 20% детей и от 1 до 7% взрослых. По статистике у 45% детей, заболевших АтД, симптомы появились в течение первых 6 мес жизни, у 60% – на первом году жизни и у 85% больных – до 5-летнего возраста. Распространенность АтД в Российской Федерации у детей выше в 11,7 раза, заболеваемость – в 15,6 раза, чем у взрослых. При такой высокой заболеваемости и распространенности у детей количество дерматологических коек для детей в 2021 г. в РФ составляло всего – 1009 (19% от взрослого дерматологического коечного фонда – 5062).
По данным годовых отчетов кожно-венерологического отделения клиники СПбГПМУ, представленным в табл. 1, видно, что первое место в структуре кожных заболеваний у детей занимает АтД, с динамикой роста от 46% до 49,6%.
Таблица 1. Структура дерматозов у детей, находившихся на стационарном лечении в кожно-венерологическом отделении клиники СПбГПМУ с 2019 по 2021 г.
|
Заболевания
|
2019 г.
|
|
2020 г.
|
|
2021 г.
|
|
|
|
n
|
%
|
n
|
%
|
n
|
%
|
|
АтД
|
652
|
46%
|
492
|
41,3%
|
1061
|
49,6%
|
|
Псориаз
|
278
|
20%
|
240
|
19,8%
|
506
|
23,6%
|
|
Пиодермии
|
47
|
3%
|
68
|
5,7%
|
101
|
4,7%
|
|
Себорейный дерматит грудных детей
|
10
|
0,71%
|
24
|
2%
|
7
|
0,32%
|
|
Склеродермия
|
148
|
10,5%
|
161
|
11,2%
|
176
|
8,23%
|
|
Токсикодермия
|
60
|
4,27%
|
123
|
9,7%
|
69
|
5,57%
|
|
Акне
|
30
|
2,13%
|
72
|
5,9%
|
17
|
0,79%
|
|
Болезни волос
|
41
|
2,92%
|
28
|
2,3%
|
73
|
3,41%
|
|
Врожденный ихтиоз
|
–
|
–
|
9
|
0,76%
|
11
|
0,5%
|
АтД представляет собой сложное кожное воспалительное заболевание с многофакторной причиной, включающей сложное взаимодействие дефектов эпидермального барьера, иммунной дисрегуляции как адаптивного, так и врожденного иммунитета, а также окружающей среды. Продолжаются споры о том, является ли АтД следствием генетических мутаций, влияющих на эпидермальный барьер (модель снаружи–внутрь), или вызвана воспалением, подавляющим дифференцировку эпидермиса (модель изнутри–наружу) [2]. Нарушение барьерной функции кожи связано с состоянием микробиоты. В рекомендациях EADV 2018 г. Staphylococcus аureus назван основным триггером АтД [3], при этом долгосрочное применение местных антибиотиков не рекомендуется из-за риска роста антибиотикорезистентности и сенсибилизации, показано применение местных антисептиков, особенно при хроническом течении и снижении ответа на стандартную терапию, а также местных противогрибковых средств при преимущественном поражении «голова и шея» и при наличии IgE к Malassezia spp.
Токсины St. аureus
являются суперантигенами, которые вызывают активацию Т-клеток, экспрессию антистафилококковых антител IgE, увеличивают экспрессию рецепторов интерлейкина-31 (ИЛ-31), что предрасполагает к развитию зуда. Хроническое воспаление, зуд и расчесывание в сочетании с дефицитом антимикробных липидов играют важную роль в снижении колонизационной резистентности эпидермиса больных АтД и формируют порочный круг, усугубляя нарушение барьерной функции.
Сухость кожи является одним из характерных симптомов АтД. В настоящее время имеются научные данные о генетически обусловленных аномалиях кожного барьера у людей и мышей, которые облегчают проникновение аллергена в кожу и предрасполагают к развитию раздражения и последующего воспаления в коже. Дефицит филаггрина является наиболее четко определенной аномалией, которая приводит к дефициту молекул, образующихся в процессе катаболизма филаггрина и обладающих высокой гигроскопичностью. Кроме того, недостаток межклеточных липидов рогового слоя и неадекватное соотношение соединений (холестерин, незаменимые жирные кислоты, церамиды) усиливают трансэпидермальную потерю воды, что способствует микроповреждениям эпидермиса. Нарушение кожного барьера предрасполагает к развитию воспаления.
Основная терапия направлена на восстановление нарушенной барьерной функции и элиминацию триггеров. Смягчающие средства увлажняют эпидермис, создают окклюзионный слой, уменьшают испарение. В исследованиях было обнаружено, что эффективное и регулярное использование смягчающих средств – эмолентов – снижает потребность в местных кортикостероидах, снижает частоту и выраженность обострений. По этой причине терапия смягчающими и увлажняющими средствами является основой терапии АтД у детей и взрослых, она назначается всем пациентам независимо от степени тяжести [4–6]. Всесторонний обзор 14 независимых опубликованных клинических рекомендаций со всего мира (США, Великобритания, Европа, Япония, Корея, Сингапур, Канада, Южная Африка и отдельные европейские страны) показал, что ежедневное увлажнение и смягчение является общей рекомендацией для лечения АтД [7].
Понятие «увлажняющие средства» объединяет продукты, включающие в себя три группы веществ [8] или их комбинации: окклютанты, эмоленты, увлажнители.
К окклютантам относятся вещества, создающие гидрофобный барьер на коже (например, холестерин), что уменьшает трансэпидермальную потерю воды. Увлажнители могут увеличивать транспорт влаги из дермы в эпидермис, из глубоких/средних слоев эпидермиса – в поверхностные слои, а во влажных условиях они также помогают роговому слою поглощать воду из внешней окружающей среды. Наиболее часто используемые вещества этой группы – глицерин и мочевина. Эмоленты, обычно липиды и углеводы, заполняют промежутки между группами корнеоцитов, но не создают выраженный окклюзионный эффект. Примерами таких веществ являются пропиленгликоль и изопропилпальмитат. Иногда термин «эмолент» относится ко всем смягчающим средствам (поскольку, например, изопропилпальмитат обладает обоими свойствами), поэтому в данной работе термины смягчающие/увлажняющие средства и эмоленты будут использоваться как синонимы.
В последнее время все больше внимания уделяется эмолентам, в которые для улучшения их свойств включают дополнительные компоненты [9], например церамиды («эмоленты плюс»). Обычно «эмоленты» определяются как «средства для местного применения с веществами типа носителя, в которых отсутствуют активные ингредиенты», тогда как «эмоленты плюс» относятся к «составам для местного применения с веществами типа носителя и дополнительными активными, немедикаментозными веществами» [3].
Дефицит церамидов, по-видимому, является одним из основных изменений при АтД, и восполнение этого эпидермального компонента посредством местного применения смягчающих средств на основе церамидов является безопасным, хорошо переносимым и эффективным [10, 11]. Например, было показано, что лечение синтетическими псевдоцерамидами улучшает состояние атопичной кожи, переключая профиль церамидов на фенотип здоровой кожи. Четыре недели лечения синтетическими псевдоцерамидами значительно уменьшили выраженность кожных симптомов, что сопровождалось значительным снижением трансэпидермальной потери воды и увеличением содержания воды в роговом слое [12].
Рандомизированное контролируемое исследование смягчающего средства с церамидом и филаггрин-ассоциированными аминокислотами для первичной профилактики АтД у детей из группы высокого риска продемонстрировало, что по всем клиническим конечным точкам наблюдалась числовая тенденция в пользу его применения, хотя и статистически незначительная, вероятно, из-за недостаточного охвата. АтД был диагностирован у 13,2% против 25,0% через 12 мес (p=0,204) и у 19,4% против 31,0% через два года (p=0,296) в группе вмешательства по сравнению с контрольной группой соответственно [13]. В другом исследовании было набрано 24 ребенка с АтД. Две трети пациентов сообщили об очень хорошей или хорошей переносимости увлажняющего крема с липидными прекурсорами церамидов (ЛПЦ), тогда как одна треть сообщила об удовлетворительной или плохой переносимости. После использования увлажняющего крема ЛПЦ объективная оценка Scoring of Atopic Dermatitis (Индекс АтД, SCORAD), оценка выраженности зуда и оценка нарушений сна были ниже в группе очень хорошей/хорошей переносимости, чем в группе удовлетворительной/плохой переносимости. Улучшился средний объективный балл SCORAD (с 31,5 до 25,7; p=0,039) и улучшилась гидратация кожи (с 30,7 условных единиц (у.е.) до 36,0 у.е.; p=0,021) в группе очень хорошей/хорошей приемлемости [14]. В когортном исследовании была оценена эффективность режима приема очищающего и увлажняющего средства, содержащего церамиды, два раза в день у мужчин, женщин и детей с АтД. Срок лечения составил 6 нед. Участники младше 12 лет (n=33) были выделены в отдельную группу. На 42-й день показатели SCORAD у детей показали значительное улучшение (p=0,0001). Аналогичные эффекты наблюдались для зуда, при этом баллы улучшались от сильного зуда до зуда только тогда, когда кожа была влажной (p=0,0001) [15].
В 2021 г. государственную регистрацию в РФ и странах ЕАЭС получила увлажняющая и питающая пена для сухой чувствительной кожи Blue Cap компании CATALYSIS, S.L. (Мадрид, Испания), которая содержит в качестве активных ингредиентов церамиды (NP, AP, EOP), фитосфингозин, холестерин, глицерин, бисоболол и пироктоноламин, а также другие вещества, относящиеся ко всем трем группам веществ для смягчающих средств, такие как, например, пропиленгликоль, изопропилпальмитат и диэтилгексилеарбонат. Иными словами, эмолент усилен церамидами и холестериново-фитостерольным комплексом. Большое значение для нормализации микробиоты и подавления роста St. aureus и дрожжеподобных грибов имеют входящие в состав средства – фитосфингозин, бисоболол и пироктоноламин.
Доказано, что сфингозины обладают также активностью в отношении S. aureus и Candida albicans [16], бисоболол является не только прекрасным природным антисептиком, но и обладает противовоспалительным действием [17], поскольку снижает выработку провоспалительных цитокинов, а пироктоноламин обладает высокой противогрибковой активностью в отношении грибов Malassezia [18].
Такое средство можно отнести к группе «эмоленты плюс», лечебные увлажнители [19]. Для применения средств в педиатрической практике у детей с АтД желательно иметь данные о том, какова переносимость и эффективность этих средства, состав которых соответствует основным принципам терапии, направленной на восстановление нарушенной барьерной функции кожи и элиминацию триггеров.
Важным преимуществом пенки Blue Cap является также сама форма пены. Во-первых: пена имеет легкую воздушную текстуру, которая очень легко распределяется по поверхности (буквально несколькими легкими движениями) и быстро впитывается, что позволяет минимизировать контакт с кожей при нанесении, что особенно важно для детей. Во-вторых: герметичная упаковка, которая исключает бактериальную контаминацию и окисление содержимого, обеспечивает постоянство состава и микробиологическую чистоту. Это важное преимущество средства, поскольку в рекомендациях EADV-2018 «Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children» приводятся данные, что кремы и мази, которые пациенты используют, становятся контаминированы бактериально в 53% случаев, в 25% случаев контаминированы St. aureus
[3, 20].
Цель и задачи
Целью исследования являлось изучение влияния многокомпонентной пены-эмолента на течение АтД легкой и средней степени тяжести.
Для достижения поставленной цели были поставлены следующие задачи: оценить динамику изменений тяжести АтД в процессе лечения при использовании комбинированной пены-эмолента для увлажнения; оценить динамику показателей увлажненности кожи, трансэпидермальной потери воды и рН кожи; изучить взаимосвязь изменений тяжести АтД и показателей барьерной функции кожи в процессе применения препарата; проанализировать оценку пациентами и/или их законными представителями органолептических свойств и удобства применения препарата.
Материал и методы
В исследование были включены 30 пациентов с легкой и средней степенью АтД в возрасте от 3 до 17 лет. Критериями включения были подтвержденный (на основании критериев HANIFIN и RAJKA [21]) диагноз АтД со значениями индекса SCORAD менее 50 баллов. Экссудативная, эритематозно-сквамозная с/без лихенификации или лихеноидная клинико-морфологическая форма АтД в стадии обострения основного заболевания с выраженными клиническими проявлениями без мокнутия и вторичной инфильтрации кожи или стадия неполной ремиссии при ограниченно-локализованной распространенности кожного процесса. Также от пациентов и/или их законных представителей требовалось согласие не применять запрещенные препараты в течение всего срока исследования. К запрещенным препаратам относились любые другие косметические средства или местные лекарственные препараты с увлажняющим действием (эмоленты), топические ингибиторы кальциневрина, любые местные и системные глюкокортикостероиды, любые системные иммуносупрессанты, системные антибактериальные и противовирусные препараты, системные антигистаминные препараты. Также запрещена была на время исследования фототерапия ультрафиолетовым излучением.
Информация по проведению ЛЭК. (Французская клиника кожных болезней Пьера Волькенштейна, Санкт-Петербург, заседание ЛЭК 05/2022 от 15.03.2022, протокол BLC-2022. Исследование проводилось 25.03.–27.05.2022) Все участники исследования и/или их законные представители до включения в исследование дали информированное согласие на участие.
Использовалась увлажняющая и питающая пена для сухой чувствительной кожи Blue Cap1. Режим использования предполагал нанесение на пораженные участки, кожу, окружающую их, и кожу с признаками сухости. Препарат наносился на хорошо очищенную и сухую кожу, не менее одного раза в день на протяжении 4 нед.
За время участия в исследовании были предусмотрены 3 визита – первоначальный визит, промежуточный визит в середине исследования и визит завершения исследования. Общее время участия в исследовании составило от 26 до 31 дня.
На всех визитах проводилась оценка степени тяжести заболевания по индексам SCORAD и ESAI, а также общая оценка тяжести АтД исследователем (IGA); анализировались интенсивность ксероза и интенсивность зуда с помощью визуальной аналоговой шкалы (ВАШ: ВАШ-К и ВАШ-З соответственно). На каждом визите проводилось измерение объективных показателей барьерной функции кожи в виде ее увлажненности (метод корнеометрии), трансэпидермальной потери воды (ТЭПВ, метод тэваметрии/вапометрии) и рН с помощью тест-системы Multiskin Test Center MC750. По завершении применения препарата оценивались органолептические свойства Blue Cap, пенка, и удовлетворенность от его использования.
В качестве референсных использовались значения ТЭПВ<25 г/ч×м2 и рН кожи 4,5–5,5. Для интерпретации степени увлажненности кожи (поскольку метод корнеометрии является полуколичественным [22]) использовались границы, приведенные в табл. 2.
Таблица 2. Интерпретация показателей увлажненности кожи [23]
|
Значение
|
Уровень влажности
|
Подробная информация
|
|
|
45–99,9
|
Очень высокий
|
45–99,9
|
Очень высокий
|
|
30–44,9
|
Нормальный
|
40,1–44,9
|
Высокий нормальный
|
|
|
|
35,1–40
|
Средний нормальный
|
|
|
|
30–35
|
Низкий нормальный
|
|
0–29,9
|
Низкий
|
20,1–29,9
|
Низкий
|
|
|
|
Ниже 20
|
Очень низкий
|
Тяжесть заболевания устанавливалась на основании значения индекса SCORAD [24]: легкая степень – менее 25 баллов, средняя степень – от 25 до 50 баллов, тяжелая – более 50 баллов. Оценка EASI находится в диапазоне от 0 до 72 [25]. На чистую кожу или на отсутствие экземы указывает 0 баллов; от 0,1 до 1,0 указывает на почти полное отсутствие экземы; от 1,1 до 7 указывает на легкое заболевание; от 7,1 до 21 указывает на умеренное заболевание; от 21,1 до 50 указывает на тяжелое заболевание и больше 51 балла указывает на очень тяжелое заболевание.
Как вспомогательные показатели рассчитывались индексы SCORAD 25, SCORAD 50 и SCORAD 100, что означает улучшение балльных показателей на 25, 50 и 100% соответственно.
Для статистического анализа данных использованы методы непараметрической статистики, ввиду малой численности группы и невозможности исключить отклонения от нормальности распределения, а также полуколичественный характер ряда переменных. Статистическая обработка результатов включала в себя расчет медианы изменений значений количественных показателей и их межквартильного расстояния, а также оценку медианы и межквартильных расстояний по визитам. Для оценки значимости изменений между визитом 1 и визитом 3 показатели сравнивались с использованием парного теста Вилкоксона. Связи объективных показателей барьерной функции кожи с индексами тяжести АтД изучались на основе ранговых коэффициентов корреляции Спирмена. При проведении качественной оценки объективных показателей барьерной функции кожи и глобальных индексов проводился расчет доли пациентов в определенных группах и расчет точного 95% доверительного интервала (ДИ) для доли (Клоппера–Пирсона). В качестве пограничного значения для принятия решения об отклонении нулевой гипотезы, об отсутствии значимой динамики или различий в долях был выбран уровень ошибки типа I в 5% (т.е. для отклонения нулевой гипотезы требовалось p<0,05). Статистическая обработка данных была выполнена в системе R (версия 3.5).
Результаты
Основные результаты оценки изменений измеряемых показателей за время исследования приведены в табл. 3.
Таблица 3. Изменение основных показателей за период лечение пенкой Blue Cap
|
Показатель
|
Медиана (IQR) значения
|
|
|
Медиана изменений визит 1–3 (IQR)
|
р по тесту Вилкоксона
|
|
|
Визит 1
|
Визит 2
|
Визит 3
|
|
|
|
SCORAD
|
34,45 (15,78)
|
22,15 (14,48)
|
12,2 (13,53)
|
22,8 (7,65)
|
<0,001
|
|
EASI
|
5,05 (2,38)
|
3,55 (2,47)
|
2 (2,13)
|
3,1 (1,8)
|
<0,001
|
|
IGA
|
2 (1)
|
2 (1)
|
1 (1)
|
1 (0)
|
<0,001
|
|
ВАШ-З
|
6 (2)
|
4 (3)
|
2 (1,75)
|
4 (1,75)
|
<0,001
|
|
ВАШ-К
|
6 (1)
|
5 (1,75)
|
3 (2)
|
4 (2,75)
|
<0,001
|
|
ТЭПВ (вапометрия, г/ч×м2)
|
33,55 (3,95)
|
29,95 (3,73)
|
28,95 (4,65)
|
5,45 (3,53)
|
<0,001
|
|
Увлажненность (корнеометрия)
|
21,05 (5,83)
|
24 (4,79)
|
25,95 (3,13)
|
-4,95 (4,48)
|
<0,001
|
|
pH
|
5,9 (0,4)
|
5,5 (0,75)
|
5,7 (0,48)
|
0,2 (0,68)
|
0,002
|
Примечание. IQR – межквартильное расстояние.
Как видно из табл. 3, за время исследования произошли значимые изменения всех измеренных показателей. Индекс SCORAD уменьшился на 22,8 балла – с 34,5 до 12,2 баллов (р<0,001), EASI – на 3,1 балла – с 5,1 до 2 баллов (р<0,001). На 4 балла (из 10 возможных) уменьшились оценки выраженности зуда и ксероза по ВАШ (p<0,001 в обоих случаях). На 5,5 г/ч×м2 уменьшилась ТЭПВ (р<0,001) и увеличилась увлажненность кожи (на 23,5% от исходного). Значимо снизился, на 0,2 единицы, и рН кожи (р=0,002), однако медианное значение для группы находилось выше верхней границы нормы, продолжая оставаться в более щелочном диапазоне.
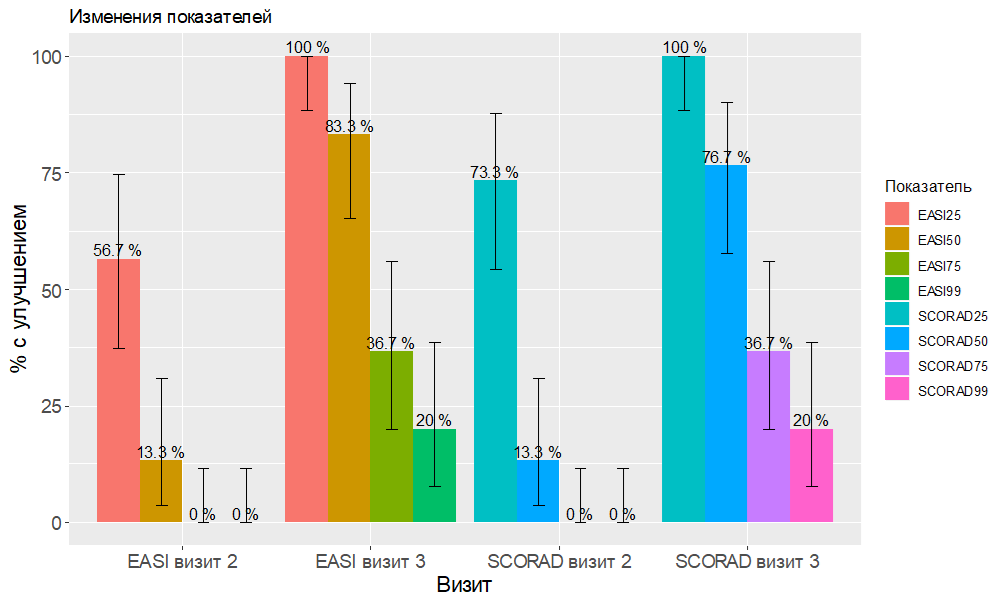
На втором визите у всех пациентов было зафиксировано клиническое улучшение: SCORAD 25 достигли 73,3% (95% ДИ 57,7–90,1%) пациентов, SCORAD 50 – 13,33% (95% ДИ 3,7–30,7%). На финальном визите SCORAD 100 и SCORAD 75 достигли 20% (95% ДИ 7,7–20,6%) и 36,7% (95% ДИ 19,9–56,1%) пациентов соответственно (р<0,01), также улучшился индекс EASI (рис. 1).
Рис. 1. Процентное улучшение индексов SCORAD и EASI на втором и третьем визитах. (Обозначение SCORAD99 означает индекс SCORAD 100.)
В процентном выражении улучшения показателей увлажненности кожи, ТЭПВ и рН были меньшими, поэтом для них рассчитывалась доля людей с улучшением хотя бы на 10%, но не приводятся данные по улучшению на 100% и 75% (рис. 2 и 3).
Рис. 2. Процентное улучшение влажности кожи на втором и третьем визитах от исходного уровня.)
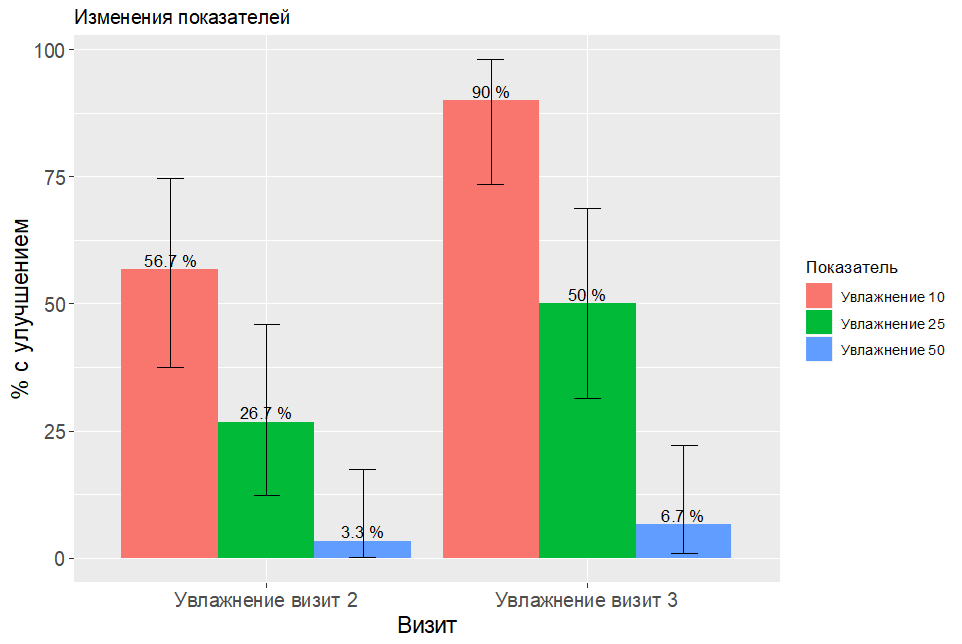
Рис. 3. Процентное улучшение (снижение) ТЭПВ и рН в зависимости от исходного уровня. Поскольку улучшения на 50% не было, данные не приводятся.
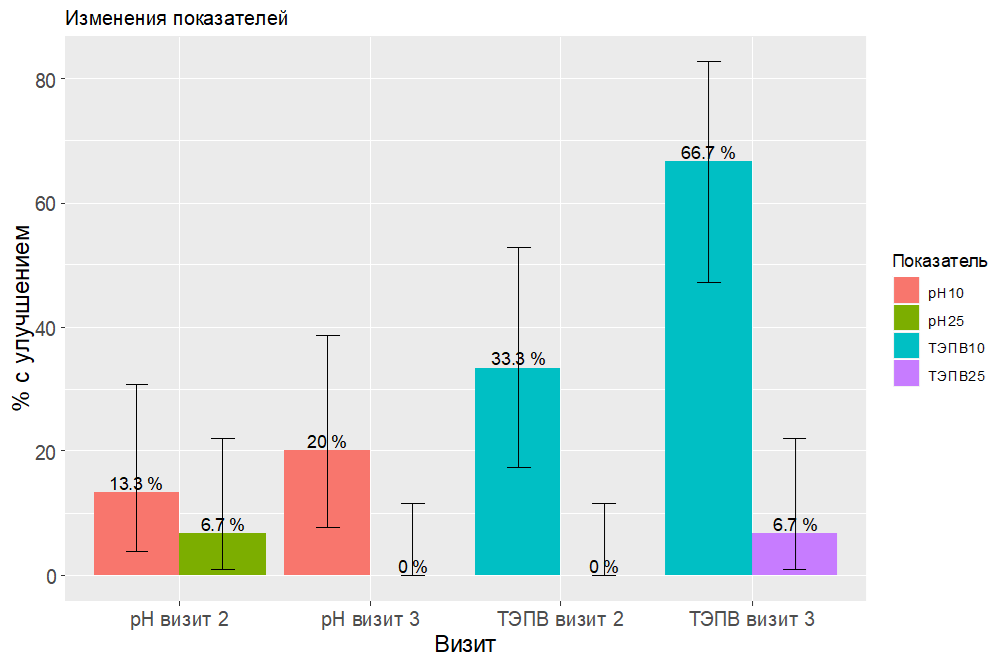
На рисунках приведены доверительные интервалы Клоппера–Пирсона, поскольку при нулевых значения они определены, то на соответствующих позициях нет столбиков, но есть интервал (при 0 верхняя граница находится на уровне 11,6%).
Таким образом, были выявлены значимые благоприятные изменения показателей, однако требовался более детальный качественный анализ с целью определения того, насколько клинически значимыми они были. Результаты данного анализа представлены в табл. 4.
Таблица 4. Качественная оценка объективных показателей барьерной функции кожи и глобальных индексов по визитам
|
Показатель
|
% (n); 95% ДИ
|
|
|
|
|
Визит 1
|
Визит 2
|
Визит 3
|
|
Увлажненность (низкая)
|
100 (30); 88,4–100
|
93,3 (28); 77,9–99,2
|
86,7 (26); 69,3–96,2
|
|
ТЭПВ (увеличенная)
|
100 (30); 88,4–100
|
100 (30); 88,4–100
|
100 (30); 88,4–100
|
|
рН (отклонения от нормы)
|
86,7 (26); 69,3–96,2
|
56,7 (17); 37,4–74,5
|
63,3 (19); 43,9–80,1
|
|
SCORAD (>25)
|
86,7 (26); 69,3–96,2
|
46,7 (14); 28,3–65,7
|
10,0 (3); 2,1–26,5
|
|
EASI (>1)
|
100 (30); 88,4–100
|
96,7 (29); 82,8–99,9
|
63,3 (19); 43,9–80,1
|
|
IGA (>1)
|
93,3 (28); 77,9–99,2
|
53,3 (16); 34,3–71,7
|
46,7 (14); 28,3–65,7
|
Как видно из этой табл.4, наибольшая положительная динамика была отмечена для индекса SCORAD: если на визите включения в исследование 87% (95% ДИ 69–96%) всех пациентов имели значения индекса, превышающие 25 (средняя степень тяжести заболевания), то к визиту завершения лечения таких осталось только 10% (95% ДИ 2,1–26,5%). Поскольку доверительные интервалы не перекрывались, то это означает, что доля лиц со средней степенью тяжести заболевания значимо сократилась. Если смотреть на индекс EASI, то на визите 1 все пациенты имели значения, превышавшие 1, т.е. имели хотя бы легкое заболевание. К визиту завершения исследования таких осталось 63% (95% ДИ 44–80%), опять-таки снижение было достоверным и, фактически, у 37% пациентов кожа практически очистилась (менее 1 балла по EASI получают пациенты с чистой кожей и/или отсутствием экземы, либо почти полным отсутствием экземы). В то же время динамика объективных показателей в качественной интерпретации была выражена меньше.
Для того чтобы подробнее разобраться в связях между индексами тяжести заболевания и объективными показателями барьерной функции кожи, был выполнен ранговый корреляционный анализ, результаты которого представлены в табл. 5.
Таблица 5. Связь объективных показателей состояния кожи и суммарных индексов тяжести АтД
|
Показатели
|
Визит
|
Корреляционные коэффициенты Спирмена (n=30); р оценка
|
|
|
|
|
|
|
|
|
SCORAD
|
|
|
EASI
|
|
|
|
|
|
Визит 1
|
Визит 2
|
Визит 3
|
Визит 1
|
Визит 2
|
Визит 3
|
|
Увлажненность
|
1
|
-0,41704; 0,0219
|
-0,45117; 0,0123
|
-0,35934; 0,0511
|
-0,44057; 0,0148
|
-0,43532; 0,0162
|
-0,45532; 0,0115
|
|
|
2
|
-0,52632; 0,0028
|
-0,42279; 0,0199
|
-0,48839; 0,0062
|
-0,57001; 0,0010
|
-0,50212; 0,0047
|
-0,55901; 0,0013
|
|
|
3
|
-0,75769; <0,0001
|
-0,64766; 0,0001
|
-0,72392; <0,0001
|
-0,76719; <0,0001
|
-0,67194; <0,0001
|
-0,75328; <,0001
|
|
ТЭПВ
|
1
|
0,68024; <0,0001
|
0,53461; 0,0023
|
0,62132; 0,0002
|
0,64585; 0,0001
|
0,65134; <0,0001
|
0,64052; 0,0001
|
|
|
2
|
0,76927; <0,0001
|
0,62287; 0,0002
|
0,66324; <0,0001
|
0,76217; <0,0001
|
0,74663; <0,0001
|
0,66995; <,0001
|
|
|
3
|
0,60134; 0,0004
|
0,49054; 0,0059
|
0,50537; 0,0044
|
0,58239; 0,0007
|
0,49432; 0,0055
|
0,51018; 0,0040
|
|
pH
|
1
|
-0,11711; 0,5377
|
0,04094; 0,8299
|
-0,07611; 0,6894
|
-0,08708; 0,6473
|
-0,20652; 0,2736
|
-0,06985; 0,7138
|
|
|
2
|
-0,08792; 0,6441
|
-0,00357; 0,9850
|
-0,08388; 0,6595
|
-0,18060; 0,3396
|
-0,28013; 0,1338
|
-0,12175; 0,5216
|
|
|
3
|
-0,17462; 0,3560
|
-0,16399; 0,3865
|
-0,24562; 0,1908
|
-0,17837; 0,3456
|
-0,01353; 0,9434
|
-0,14574; 0,4422
|
Как видно из табл. 5, увлажненность кожи достоверно коррелировала с показателями как SCORAD, так и EASI. Единственным исключением была связь между увлажненностью на первом визите и индексом SCORAD на третьем, хотя и тут наблюдалось приближение к границе достоверности (р=0,051). Степень связи со значениями индекса SCORAD была умеренной для увлажненности на первом визите (около 0,36–0,45) и выраженной для показателя увлажненности на третьем визите (0,65–0,76). Аналогичное было справедливо для индекса EASI. При этом, как и ожидалось, корреляция была негативной, указывая на то, что более высокие оценки SCORAD и EASI ассоциированы с меньшей увлажненностью кожи. Интересно, что показатели ТЭПВ на всех визитах были выраженно связаны с балльной оценкой тяжести АтД (коэффициенты корреляции 0,5–0,7, р<0,05 во всех случаях). Следует отметить, что корреляционная матрица включала большое количество (54) коэффициентов корреляции и можно было утверждать, что оценка достоверности связи на уровне 0,05 завышает ошибку типа I. Однако если использовать поправку Бонферрони (понизить уровень значимости на число сравнений), то пограничный уровень значимости для коэффициентов корреляции становится равным 0,0009. А, как видно из табл. 5, в большинстве случаев коэффициенты корреляции ТЭПВ и балльной оценкой тяжести АтД имели значимость ниже даже этой, крайне консервативной границы. Поэтому можно было утверждать, что тяжесть АтД связана с ТЭПВ (чем сильнее, тем выше балл) и увлажненностью (чем выше, тем ниже балл) и, если принять во внимание тот факт, что связь была сильнее для показателей на визите 3 (по окончанию лечения), то можно предположить, что исходная тяжесть заболевания была связана со степенью восстановления барьерной функции под влиянием применения пенки Blue Cap.
Как видно из табл. 5, рН кожи не был связан с оценками тяжести течения АтД ни на одном из визитов, показывая, что, по крайней мере, в этой небольшой выборке, связь рН и тяжести течения АтД с учетом ее изменения в течение наблюдения, невысока.
Корреляция существовала и между увлажненностью кожи и оценками зуда (ВАШ-З) и ксероза (ВАШ-К), в особенности на визите 3, хотя связь была слабее для ВАШ-К на визите 3. ТЭПВ на первом, втором и третьем визитах была ассоциирована ВАШ-К на третьем визите. ТЭПВ на первом и втором визитах были ассоциированы с ВАШ-З, однако для ТЭПВ на третьем визите связь была слабее.
Кроме оценки описанных выше показателей в конце исследования было оценено мнение пациентов и/или их законных представителей о самом препарате. Запах был оценен 57% (95% ДИ 37,4–74,5%) на «отлично» и 43% (95% ДИ 25,5–62,6%) на «хорошо». Оценок «удовлетворительно» и «неудовлетворительно» не было. Консистенцию на «отлично» оценили 57% (95% ДИ 37,4–74,5%), на «хорошо» 33% (95% ДИ 17,3–52,8%) и на «удовлетворительно» 10% (95% ДИ 2,1–26,5%) опрошенных. Оценок «не удовлетворительно» не было. Удобство применения оценили на «отлично» 67% (95% ДИ 47,2–82,7%), на «хорошо» – 30% (95% ДИ 14,7–49,4%) и на «удовлетворительно» – 3% (95%ДИ 0,1–17,2%) опрошенных. Можно было констатировать, что органолептические свойства и удобство применения были оценены достаточно высоко. Согласно проведенному исследованию 1 раз в день (меньше, чем в инструкции по применению) пенку использовали от 3,1% до 18,7% пациентов, 2 раза в день от 7,9% до 48,4% пациентов, 10,1% – 63,1% наносили 3 раза в день. Подлежит дальнейшему изучению, насколько большая стандартизация частоты нанесения пенки может способствовать нормализации барьерной функции кожи. Всем пациентам даны рекомендации по диете и лечению, так как по нашим данным, 40,1% подростков и 38,2% родителей предпочитают не рассказывать врачу о нарушениях режима питания и лечения [26–29].
Таким образом, использование пенки Blue Cap в терапии АтД легкой и средней степени тяжести у детей хорошо переносилось и было ассоциировано с выраженным улучшением течения заболевания, а также положительными изменениями объективных показателей барьерной функции кожи.
Выводы
- Тяжесть АтД у детей, кожа которых обрабатывалась пенкой Blue Cap, уменьшилась: по индексу SCORAD на 22,8 балла, по индексу EASI – на 3,1 балла (в обоих случаях p<0,001).
- Увеличилась увлажненность кожи (на 23,5% по сравнению с исходным), снизилась ТЭПВ (на 5,45 г/ч×м2) – в обоих случаях p<0,001; pH кожи снизился в сторону нормального на 0,2 единицы (р=0,002).
- Показатели увлажненности кожи и ТЭПВ коррелируют со степенью тяжести АтД со снижением тяжести при росте увлажненности и снижении ТЭПВ.
- Оценка 97% пациентов и/или их законных представителей удобства применения на «отлично» и «хорошо» подтверждает преимущество формы пены, которая позволяет минимизировать контакт с кожей при нанесении, обеспечивая быстроту, комфорт и минимальный риск раздражения, что особенно важно для детей.
- На основании полученных результатов пена Blue Cap рекомендована в качестве стандартной терапии АтД у детей.
Приложение
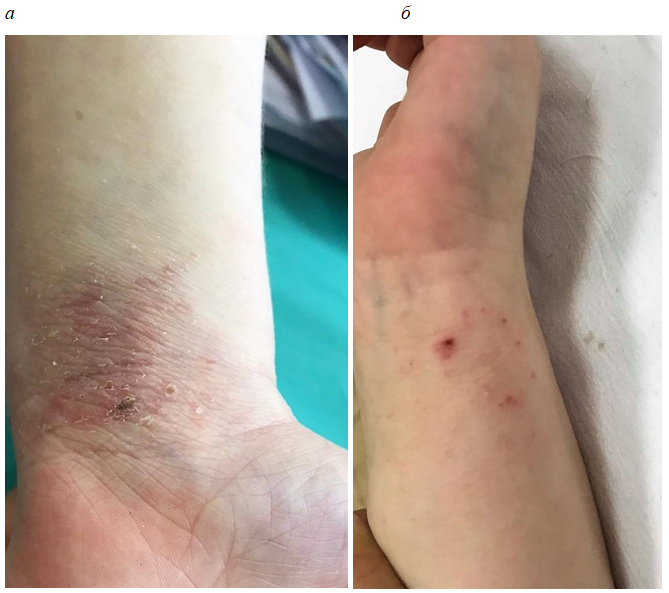
Фотографии пациентов до лечения и после 4-недельного применения исследуемого препарата представлены на рис. 4–6.
Рис. 4. Пациент А., АтД, среднетяжелая степень тяжести до (а) и после 4-недельного применения исследуемого препарата (б).
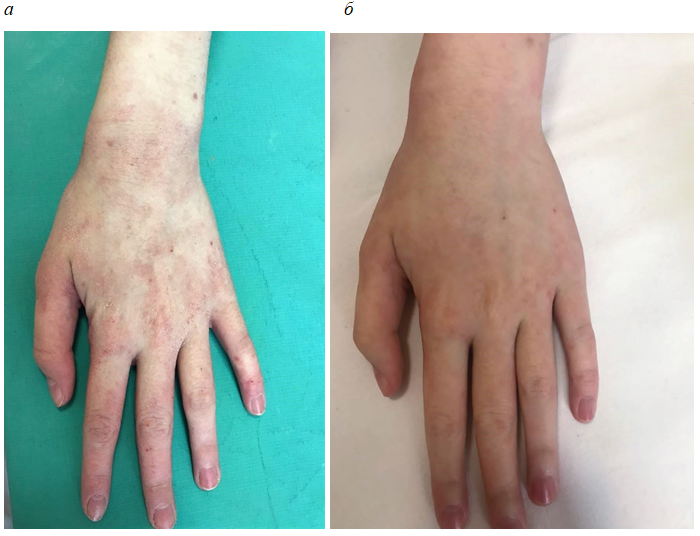
Рис. 5. Пациент Б., АтД, среднетяжелая степень тяжести до (а) и после 4-недельного применения исследуемого препарата (б).
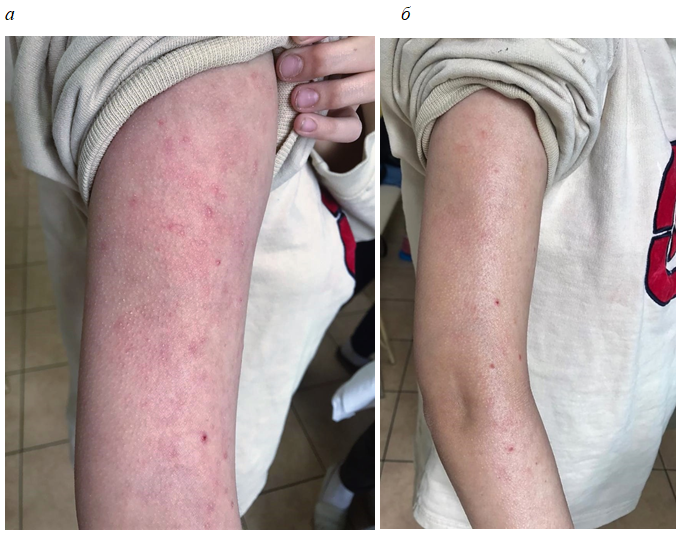
Рис. 6. Пациент С., АтД, среднетяжелая степень тяжести до (а) и после 4-недельного применения исследуемого препарата (б).
Литература
- Roduit C, Frei R, Depner M et al. Phenotypes of Atopic Dermatitis Depending on the Timing of Onset and Progression in Childhood. JAMA Pediatr 2017; 171 (7): 655–62.
- Saini S, Pansare M. New Insights and Treatments in Atopic Dermatitis. Pediatr Clin North Am 2019; 66 (5): 1021–33.
- Wollenberg A, Barbarot S, Bieber T et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part II. J Eur Acad Dermatol Venereol 2018; 32 (6): 850-78. DOI: 10.1111/jdv.14888
- Lewis-Jones S, Mugglestone MA. Management of atopic eczema in children aged up to 12 years: summary of NICE guidance. BMJ 2007; 335 (7632): 1263–4.
- Strathie Page S, Weston S, Loh R. Atopic dermatitis in children. Aust Fam Physician 2016; 45 (5): 293–6.
- Атопический дерматит. Клинические рекомендации. М., 2021. URL: https://cr.minzdrav.gov.ru/recomend/265_2
- LePoidevin LM, Lee DE, Shi VY. A comparison of international management guidelines for atopic dermatitis. Pediatr Dermatol 2019; 36 (1): 36–65.
- Заславский Д.В., Баринова А.Н. Микробиом кожи при атопическом дерматите и особенности различных средств базисного ухода за кожей. Медицинский совет. 2018; 2: 170–6.
- Заславский Д.В., Баринова А.Н. Новая стратегия базовой увлажняющей терапии при атопическом дерматите – «эмоленты плюс». Дерматовенерология. Косметология. 2019; 5 (1): 69–79.
- Pacha O, Hebert AA. Treating atopic dermatitis: safety, efficacy, and patient acceptability of a ceramide hyaluronic acid emollient foam. Clin Cosmet Investig Dermatol 2012; 5: 39–42.
- Fujii M. The Pathogenic and Therapeutic Implications of Ceramide Abnormalities in Atopic Dermatitis. Cells 2021; 10 (9).
- Ishida K, Takahashi A, Bito K et al. Treatment with Synthetic Pseudoceramide Improves Atopic Skin, Switching the Ceramide Profile to a Healthy Skin Phenotype. J Invest Dermatol 2020; 140 (9): 1762–70.
- McClanahan D, Wong A, Kezic S et al. A randomized controlled trial of an emollient with ceramide and filaggrin-associated amino acids for the primary prevention of atopic dermatitis in high-risk infants. J Eur Acad Dermatol Venereol 2019; 33 (11): 2087–94.
- Hon KL, Pong NH, Wang SS et al. Acceptability and efficacy of an emollient containing ceramide-precursor lipids and moisturizing factors for atopic dermatitis in pediatric patients. Drugs RD 2013; 13 (1): 37–42.
- Lynde CW, Andriessen A. A cohort study on a ceramide-containing cleanser and moisturizer used for atopic dermatitis. Cutis 2014; 93 (4): 207–13.
- Fischer CL, Drake DR, Dawson DV et al. Antibacterial activity of sphingoid bases and fatty acids. Biol Chem 2010, 391 (1): 65–71.
- Anil K Maurya at al. α-(-)-bisabolol Reduces Pro-inflammatory Cytokine Production and Ameliorates Skin Inflammation. Current Pharmaceutical Biotechnology 2014; 15: 173–81.
- Hae Jeong Youn at al. Efficacy and Safety of Cream Containing Climbazole/Piroctone Olamine for Facial Seborrheic Dermatitis: A Single-Center, Open-Label Split-Face Clinical Study. Ann Dermatol 2016; 28 (6).
- Hebert AA, Rippke F, Weber TM, Nicol NH. Efficacy of Nonprescription Moisturizers for Atopic Dermatitis: An Updated Review of Clinical Evidence. Am J Clin Dermatol 2020; 21 (5): 641–55.
- Chiu LS, Chow VC, Ling JM, Hon KL. Staphylococcus aureus carriage in the anterior nares of close contacts of patients with atopic dermatitis. Arch Dermatol 2010; 146: 748–52.
- HanifIn JM, Rajka G. Diagnostic features of atopic dermatitis. Acta Derm Venereol (Suppl). 1980; 92: 44–7.
- Панова О.С., Губанова Е.И., Лапатина Н.Г. и др. Современные методы оценки гидратации и биомеханических свойств кожи. Вестник дерматологии и венерологии. 2009; 2: 80–7.
- Пинсон И.Я., Верхогляд И.В. Клиническая оценка эффективности радиочастотного фракционного воздействия при инволюционных изменениях кожи. Российский журнал кожных и венерических болезней. 2017; 20 (5): 297–304.
- Oranje AP. Practical issues on interpretation of scoring atopic dermatitis: SCORAD Index, objective SCORAD, patient-oriented SCORAD and Three-Item Severity score. Curr Probl Dermatol 2011; 41: 149–55.
- Hanifin JM, Baghoomian W, Grinich E et al. The Eczema Area and Severity Index-A Practical Guide. Dermatitis 2022; 33 (3): 187–92.
- Юрьев В.К., Заславский Д.В., Моисеева К.Е. Методика расчета и анализ показателей деятельности учреждения здравоохранения. Учебно-методическое пособие для самостоятельной работы студентов. СПб., 2009.
- Заславский Д.В., Харбедия Ш.Д., Хведелидзе М.Г. и др. Результаты оценки пациентами деятельности медицинского персонала. В кн.: Новые горизонты: инновации и сотрудничество в медицине и здравоохранении. Материалы IX российско-немецкой научно-практической конференции Форума им. Р. Коха и И.И. Мечникова. Под общей ред. О.В. Кравченко, Г. Хана. Новосибирск: Сибирский центр деловых технологий, 2010. С. 28–9.
- Мурашкин Н.Н., Иванов А.М., Заславский Д.В., Камилова Т.А. Вопросы эффективности и безопасности применения системных ретиноидов в терапии акне у подростков. Вестник дерматологии и венерологии. 2010; 5: 112–6.
- Юрьев В.К., Заславский Д.В., Витенко Н.В. и др. Некоторые результаты оценки пациентами качества медицинской помощи. Ученые записки СПбГМУ им. акад. И.П. Павлова. 2010; 17 (2): 5–7.
Информация об авторах
Заславский Денис Владимирович – д-р мед. наук, проф., проф. каф. дерматовенерологии, ФГБОУ ВО СПбГПМУ; E-mail: venerology@gmail.com; ORCID: 0000-0001-5936-6232; SPIN-код: 5832-9510
Баринова Анна Николаевна – д-р мед. наук, проф. каф. общественного здоровья и управления здравоохранением, ФГБОУ ВО «СЗГМУ им. И.И. Мечникова». E-mail: anna_n_barinova@mail.ru; ORCID: 0000-0002-8180-9340; SPIN-код: 2010-4354
Плавинский Святослав Леонидович – д-р мед. наук, проф. каф. педагогики, философии и права, ФГБОУ ВО «СЗГМУ им. И.И. Мечникова». E-mail: s.plavinskij@szgmu.ru; ORCID: 0000-0001-9159-6177; SPIN-код: 5660-4661
Зелянина Мария Ивановна – врач-дерматовенеролог, OOO «Клиника кожных болезней Пьера Волькенштейна». E-mail: m.zelianina@rambler.ru; ORCID: 0000-0002-0172-9763
Манылова Елена Сергеевна – врач-дерматовенеролог отделения дерматовенерологии, ФГБОУ ВО СПбГПМУ. E-mail: tulechka78@mail.ru