8/2023
Терапия

Синдром хронической усталости
Синдром хронической усталости (СХУ), так же известный как миалгический энцефаломиелит (МЭ), – заболевание, которое характеризуется постоянной и необъяснимой усталостью, сопровождающейся различными симптомами (нарушение сна, головные боли, снижение настроения и др.). СХУ приводит к существенному снижению качества жизни пациентов. Согласно мировой статистике, примерно 1% населения страдает этим заболеванием. Однако точная оценка распространенности СХУ представляет сложную задачу из-за отсутствия объективного теста для диагностики заболевания [1].
Гастроэнтерология
Helicobacter pylori и экстрагастродуоденальные заболевания
Helicobacter pylori (H. pylori) по-прежнему остается серьезной проблемой современной медицины. Считается, что половина населения в мире инфицирована H. pylori, хотя существуют значительные различия в распространенности инфекции в зависимости от географических районов [1].
У подавляющего большинства пациентов инфекция H. pylori вызывает смешанный гастрит легкой степени тяжести и часто протекает бессимптомно. У некоторых больных хронический гастрит, вызванный H. pylori, может прогрессировать до тяжелых осложнений, таких как язвенная болезнь, рак желудка и MALT-лимфома.
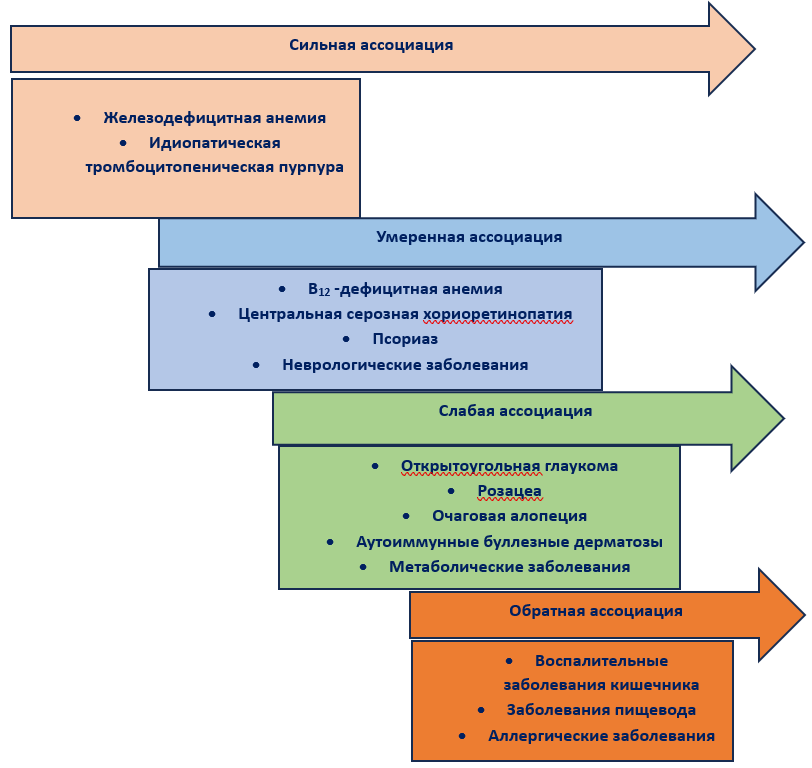
В последние годы появляется все больше доказательств положительной связи между H. pylori и некоторыми экстрагастродуоденальными заболеваниями [2].

Алгоритм диагностики и лечения инфекции H. pylori у взрослых

Как можно повысить эффективность эрадикационной терапии инфекции Helicobacter pylori?

Кашель как внепищеводное проявление ГЭРБ

Симпозиум «Многоликий абдоминальный болевой синдром»
Эндокринология

Особенности проявления начальных симптомов инсулинозависимого диабета у пациентов с сопутствующими заболеваниями
На сегодняшний день отмечается рост заболеваемости сахарным диабетом (СД) [1]. По данным отечественных ученых, средняя распространенность СД 1-го типа (СД 1) составляет 174,4 на 100 тыс. населения, СД 2-го типа (СД 2) – 2885,7 на 100 тыс., других типов СД – 61,2 на 100 тыс. населения [2].
В целом статистика показывает, что распространенность СД 1 среди взрослого населения значительно ниже распространенности СД 2, но все же отмечается увеличение заболеваемости инсулинозависимыми формами диабета среди лиц старше 18 лет.

Общие принципы выбора режима инсулинотерапии при сахарном диабете 2 типа

Дневник пациента с сахарным диабетом 2 типа, получающего инсулин

Противоревматические препараты могут предотвратить аутоиммунные заболевания щитовидной железы

Какой рентгенологический симптом определяется на рентгенограмме?
Ревматология

Профилактика и лечение остеопороза, вызванного глюкокортикоидами: обновленные рекомендации Американского колледжа ревматологов
Глюкокортикоиды (ГК) являются распространенной группой препаратов для лечения пациентов с ревматическими и неревматическими заболеваниями. Данные препараты обладают различными свойствами, в том числе оказывают противовоспалительное, иммунодепрессивное, противоаллергическое действие.
Одним из побочных эффектов применения ГК является остеопороз – заболевание, характеризующееся снижением плотности кости и повышенным риском переломов при минимальной травме. Наиболее высокая скорость снижения плотности кости наблюдается в течение первых 3–6 мес лечения ГК из-за ранней активации остеокластов с последующим снижением пролиферации остеобластов и повышением апоптоза остеобластов и остеоцитов.
Установлено, что дозы ГК <2,5 мг/сут увеличивают риск переломов позвоночника, а дозы ГК ≥2,5 мг/сут увеличивают риск переломов бедра.
Американский колледж ревматологии (American College of Rheumatology, ACR) обновил рекомендации по профилактике и лечению остеопороза, вызванного глюкокортикоидами. Обновленные рекомендации были опубликованы в журнале Arthritis & Rheumatology в октябре 2023 г. Предыдущее обновление было в 2017 г.

Лабораторные исследования, рекомендуемые для пациентов с патологическими переломами — маркерами остеопороза

Оценка риска перелома по шкале FRAX

Остеопороз: что нужно знать?


Новые горизонты в лечении СКВ

Чем опасна подагра – «болезнь королей»
Неврология

Современные возможности лечения боли в спине
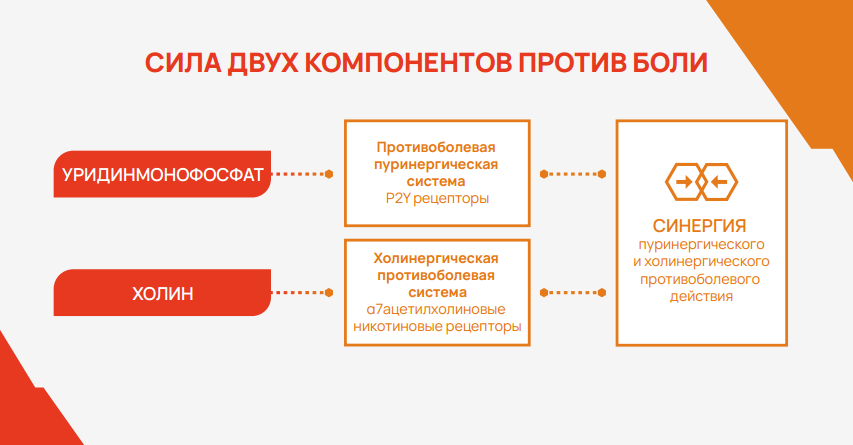
Половина обращений за медицинской помощью связана с болью, и около 50% из них составляют люди с жалобами на боль в нижней части спины1. Несмотря на широкий выбор обезболивающих лекарственных средств (нестероидные противовоспалительные препараты (НПВП), парацетамол, миорелаксанты, трамадол), купирование острой скелетно-мышечной боли не всегда бывает успешным2. До 65% людей, жалующихся на боль в спине, через год продолжают испытывать боль3. В связи с этим, во всем мире ведется активный поиск новых соединений, которые могут способствовать снижению боли, действуя не только через известные механизмы, но и посредством других систем. Одной из таких систем является пуринергическая сигнальная система, играющая важную роль в физиологических и патофизиологических процессах, в том числе связанных с болью4.
Гинекология

Диеногестсодержащий КОК - эффективный метод контрацепции у пациенток с эндометриозом
Актуальность проблемы эндометриоза обусловлена его широкой распространенностью и негативным влиянием на женское репродуктивное здоровье. К основным проявлениям эндометриоза относятся хронические тазовые боли и нарушение фертильности. Как и другие женщины, пациентки с эндометриозом нуждаются в надежной контрацепции, которая имеет свои особенности. Каким требованиям должен отвечать «идеальный» оральный контрацептив для женщин с верифицированным эндометриозом?
ГЛОССАРИЙ
МЕДИЦИНСКИЙ СЕРИАЛ

«Непокой (2017)»
Дженнифер Бреа — обладательница почётной степени доктора философии Гарварда. Она любит науку и готова заниматься ею, но внезапно оказывается поражена лихорадкой, которая приковывает её к постели. Дженнифер отправляется в виртуальное путешествие по закоулкам сознания, чтобы задокументировать свою борьбу с неизвестной медицине болезнью.
СмотретьБиблиотека практикующего врача
Святослав Логинов
«Драгоценнее многих (сборник)»
XVI век – Европа прощается со Средневековьем. Но не только в кровавых баталиях и жарких диспутах богословов рождался новый мир. Врачи переступают в это время через порог средневековой медицины. Они решаются нарушить многие запреты прошлого и подвергнуть сомнению то, что ещё совсем недавно казалось неопровержимой истиной…
Подробнее